Les bactéries phototrophes aérobies anoxygéniques (PAA).
Les bactéries PAA constituent un groupe fonctionnel de bactéries marines. Ces bactéries sont phototrophes aérobies anoxygéniques (respiration : consommation d'oxygène, photosynthèse : donneurs d'électrons mal connus, petites molécules organiques et/ou composés soufrés) (Yurkov & Beatty 1998a). Leur capacité à fixer le carbone inorganique reste un sujet de controverse, cependant il semblerait que l'importance écologique de cette fixation soit très limitée (Swingley et al. 2007). Ces bactéries se caractérisent par la présence d'un pigment collecteur de lumière, la bacteriochlorophylle a (Bchl a) (Yurkov & Beatty 1998a). Elles ont été isolées pour la première fois dans l'océan en 1979 (Shiba et al. 1979a, 1979b), mais ce n'est que très récemment que la possible importance de ces bactéries en milieu marin -et en particulier dans le cycle du carbone- a été mise en évidence (Kolber et al. 2000, Kolber et al. 2001).
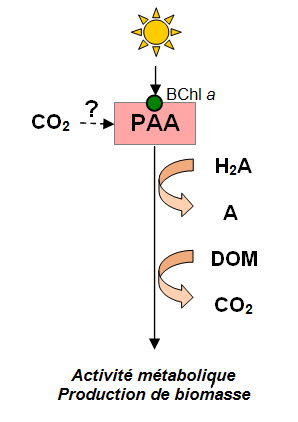
Figure 2. Métabolisme des bactéries PAA. Ces procaryotes utilisent la Bchl a comme pigment collecteur de lumière, pourraient utiliser de petites molécules organiques ou des composés soufrés comme donneurs d'électrons, pourraient fixer le CO2 (mais ce point reste très controversé). Enfin, ces bactéries utilisent l'oxygène pour la respiration.
Techniques d'étude
L'ensemble des techniques d'études des bactéries PAA repose sur leur unique caractéristique cellulaire commune, la présence de Bchl a : mesures de la concentration du pigment, détection de sa fluorescence, détection des séquences génétiques contrôlant sa voie de biosynthèse.
Approches microscopiques : dénombrements directs.
Le dénombrement des bactéries PAA est possible par microscopie à épifluorescence (Kolber et al. 2001). Après filtration sur 0,2 microns (fitres noirs, polycarbonate), les bactéries sont marquées au DAPI pour dénombrement des populations totales. La détection des bactéries PAA se fait par détection de la fluorescence de la Bchl a. Une excitation dans le bleu (390nm) provoque une fluorescence dans l'infrarouge (750nm, long pass) du pigment, ce qui permet un repérage des bactéries PAA. Une bonne détection de ces organismes doit prendre en compte une correction de la fluorescence de la chlorophylle (Chl a), car il existe une légère superposition des spectres d'émission de la Chl a et de la BChl a (Cottrell et al. 2006). L'utilisation de la microscopie à épifluoresence peut permettre un aperçu de la diversité morphologique des bactéries PAA, mais aussi une détermination de leur biovolume. L'utilisation de facteurs de conversion appropriés peut alors permettre d'estimer la biomasse (en carbone) de ces procaryotes (Fukuda et al. 1998, Sieracki et al. 2006 ).
Approches pigmentaires
La mesure des concentrations en Bchl a ou de la fluorescence de ce pigment permet d'obtenir des informations sur la distribution des bactéries PAA. Couplée à des mesures d'abondances, elle permet l'acquisition de données sur leur métabolisme et leur physiologie (Cottrell et al. 2006).
Les concentrations en BChl a peuvent être mesurées par HPLC. Il est nécessaire de filtrer des volumes relativement importants d'eau, en fonction des conditions trophiques échantillonnées (jusqu'à 5-6 litres en milieu très oligotrophe). La BChl a est détectée à 770 nm après extraction du pigment dans du méthanol. La principale difficulté technique est liée à la sensibilité des appareils, car les concentrations en Bchl a dans l'océan sont faibles comparées à celles d'autres pigments photosynthétiques. Il pourrait être envisagé le couplage d'un fluorimètre à l'HPLC et la réalisation d'une mesure de fluorescence après élution de la BChl a. Cependant, Chl b et Bchl a tendent à co-éluer : le signal de Chl b vient « contaminer » celui lié à la Bchl a. Cette difficulté est levée lorsque l'on mesure l'absorption de la BChl a à l'aide d'un DAD (détecteur de barrettes de diodes), mais ce dernier est beaucoup moins sensible que le fluorimètre.
Les mesures de fluorescence de la Bchl a d'un échantillon d'eau de mer permettent une évaluation rapide et à haut débit de l'abondance des PAA dans un environnement. Cette technique a l'avantage de pouvoir être embarquée à bord d'un navire océanographique et ainsi de donner une évaluation en temps réel de l'importance de la communauté des bactéries PAA. Les cellules phytoplanctoniques sont inhibées par l'addition de DCMU (inhibiteur du photosytème II), évitant de fausser une mesure de la fluorescence de la BChl a par celle de la Chl a (Koblizek et al. 2005).

Mesures de fluoresence de la Bchl a. Dispositif embarqué pour l'échantillonnage de la station MOLA en Méditerranée à bord du N/O Téthys II.
Approches génétiques.
La détection des bactéries PAA peut se faire par des méthodes génétiques car il existe des séquences chromosomiques spécifiques de ces procaryotes (gènes puf, codant les enzymes de la voie de biosynthèse de la Bchl a). Ces séquences peuvent être ciblées par PCR et permettre la quantification (PCR quantitative) des bactéries PAA (Schwalbach & Fuhrman 2005 , Du et al. 2006 , Waidner & Kirchman 2007). Les approches de clonage-séquençage et les approches plus récentes de métagénomique permettent de préciser la diversité et l'identité des bactéries PAA (Béjà et al. 2002 , Waidner & Kirchman 2005 , Yutin et al. 2007). La principale difficulté des approches moléculaires est liée à la nature des amorces utilisées. Ces difficultés sont en partie dues à la très large distribution phylogénétique des bactéries PAA. En particulier, les comparaisons entre les études publiées ne sont pas évidentes à cause de la variété des amorces utilisées ces dernières années. Il a été montré que certaines de ces amorces ne permettent pas de cibler l'intégralité des bactéries PAA (Yutin et al. 2005 , Waidner & Kirchman 2007). Les amorces les plus « universelles » peuvent poser des problèmes de spécificité.
Des approches culturales au séquençage complet de génomes.
De nombreuses questions concernant l'écologie, le métabolisme, la physiologie, la génétique des bactéries PAA ne pourront être résolues en s'affranchissant des approches de mise en culture. Or, très peu de souches de bactéries PAA sont aujourd'hui disponibles dans les souchothèques de bactéries marines : l'isolement de nouveaux organismes est nécessaire (PAA des groupes de Gamma- et Beta- proteobacteria en particulier). L'isolement de la souche Congregibacter litoralis (clade NOR5/OM60, Gammaproteobacteria) et le séquençage complet de son génome a permis de mieux caractériser certains aspects de la physiologie d'une bactérie PAA (i.e., croissance possible dans des conditions micro-aérobies) (Fuchs et al. 2007). De même, le séquençage complet de Roseobacter denitrificans a permis de progresser sur les mécanismes possibles de fixation du CO2 chez les PAA (Swingley et al. 2007).
Caractère généraux des bactéries PAA
Les bactéries PAA sont des procaryotes hétérotrophes (l'oxygène est utilisé au cours de la respiration) capables d'utiliser l'énergie lumineuse grâce à Bchl a, et d'utiliser H2S ou de petites molécules organiques comme donneurs d'électrons (Yurkov & Beatty 1998a). La présence de ces bactéries dans l'environnement marin est connue depuis 1979, année d'isolement des deux premières souches marines de bactéries PAA dans la Baie de Tokyo (Shiba et al. 1979a , 1979b). Des souches de bactéries PAA ont été par la suite régulièrement isolées avant d'être caractérisées (Shiba et al. 1991 , Yurkov & Beatty 1998b , Yurkov et al. 1999).
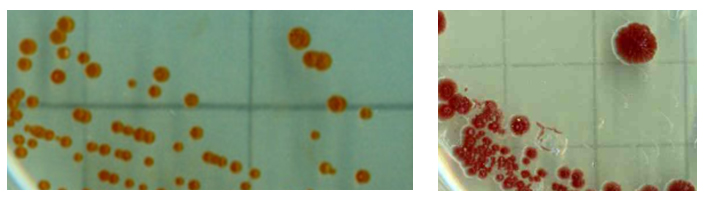
Diversité morphologique des bactéries PAA Souches de bactéries PAA issues de la collection de bactéries marines du Laboratoire Arago.
Jusqu'en 2000, très peu de travaux avaient cherché à caractériser l'importance de ces bactéries dans les océans, en particulier par l'utilisation d'approches ne faisant pas appel à une mise en culture préalable. Ainsi, des détections des concentrations en Bchl a des eaux océaniques avaient été tentées mais sans succès, comme par exemple en Mer des Sargasses (Mullins et al. 1995). La mise au point de fluorimètres plus sensibles (Kolber et al. 2000), puis la possibilité de coupler un système de détection de la fluorescence de la Bchl a à des observations par microscopie à épifluorescence (dénombrement direct des bactéries PAA) (Kolber et al. 2001) a permis en 2000 et 2001 de mettre en évidence une importance et des abondances inattendues de bactéries PAA dans l'eau de mer (Kolber et al. 2000 , Kolber et al. 2001).
Plusieurs études suggèrent une large distribution phylogénétique des bactéries PAA. Si la plupart des isolats sont restreints aux genres Roseobacter, Erythrobacter et à deux genres de Gammaproteobacteries (Cho & Giovannoni 2004, Rathgeber et al. 2004 ), des approches métagénomiques récentes conduites dans la mer des Sargasses, dans l'estuaire du Delaware et au large des côtes Californiennes ont révélé une importante diversité des séquences de gènes de PAA, démontrant ainsi que ces procaryotes se distribuent dans de nombreux groupes d'Alpha-, de Beta- et de Gamma- protéobacteries (Béjà et al. 2002 , Venter et al. 2004 , Waidner & Kirchman 2005 , Yutin et al. 2007).
Les bactéries PAA présentent une grande diversité morphologique et physiologique, reflet de leur diversité phylogénétique. Formes en bâtonnets, coques, vibrions, (Sieracki et al. 2006) présence de cils, de flagelles, (Nianzhi et al. 2003). Il existe peu de caractères communs à toutes les bactéries PAA. Seule la composition pigmentaire semble relativement constante : présence de BChl a et abondance de pigments accessoires, en particulier des caroténoides (ß-carotène, spirilloxanthine, bacteriorubixanthinal, zeaxanthine, adoadonixanthine, erythroxanthine, ) (Yurkov 1994 , Nianzhi et al. 2003).
Plusieurs études suggèrent que les bactéries PAA sont ubiquistes dans différents océans du globe. Ainsi, des bactéries PAA ont été détectées dans l'océan Atlantique (Cottrell et al. 2006), l'océan Pacifique (Kolber et al. 2001 , Cottrell et al. 2006), en mer Baltique (Koblizek et al. 2005), en mer de Chine (Zhang & Jiao 2007), en mer Rouge (Oz et al. 2005) ; dans des environnements côtiers (Sieracki et al. 2006) et hauturiers (Cottrell et al. 2006), dans des eaux oligotrophes (Kolber et al. 2001), mésotrophes (Sieracki et al. 2006), et eutrophes (Schwalbach & Fuhrman 2005). Ces procaryotes peuvent représenter des fractions non négligeables de la communauté bactérienne : jusqu'à 10% en mer Baltique (Koblizek et al. 2005), 11,3% dans l'Océan Pacifique Nord (Kolber et al. 2001), 18% sur la côte est-américaine (Schwalbach & Fuhrman 2005), 20% en Mer de Chine (Du et al. 2006). Une souche PAA a aussi été isolée à partir d'eau prélevée à proximité des évents de la ride medio-océanique Juan de Fuca. La photosynthèse pourrait y être fonctionnelle grâce à l'existence de flashs lumineux liés à la présence d'un très fort gradient géothermique dans ces zones de formation des planchers océaniques (Yurkov & Beatty 1998b).
Une écologie et un rôle biogéochimique encore mal compris.
L'écologie des bactéries PAA reste mal comprise, notamment en raison du manque de données relatives à l'organisation spatio-temporelle de ce groupe fonctionnel. D'une part, le nombre d'études publiées sur ce groupe fonctionnel est très limité. Peu d'échantillonnages de bactéries PAA ont été réalisés. Les milieux côtiers mésotrophes échappent peut-être à cette observation, mais rares sont les travaux qui ont ciblé les milieux hauturiers et en particulier les grands gyres oligotrophes océaniques qui représentent pourtant près de 60% de la surface de l'océan mondial.
Par ailleurs, les hypothèses formulées initialement pour expliquer la distribution des bactéries PAA n'ont pas permis d'expliquer les observations de terrain. Une première hypothèse a soulevé la question de leur importance dans les environnements oligotrophes. La capacité de ces procaryotes à utiliser l'énergie lumineuse et chimique pouvait laisser penser à une adaptation aux environnements pauvres en nutriments. Les bactéries PAA auraient ainsi le potentiel de basculer sur un mode de production d'énergie de type phototrophe dans les conditions où les sources de carbone sont rares (Kolber et al. 2001). Néanmoins, cette hypothèse a été contredite par de nombreuses études. Bien que les bactéries PAA puissent représenter des fractions non négligeables de la communauté procaryotique en milieu oligotrophe (Kolber et al. 2001), elles peuvent aussi être abondantes en milieu mésotrophe ou eutrophe (Schwalbach & Fuhrman 2005 , Sieracki et al. 2006). Plusieurs auteurs ont cherché d'autres facteurs environnementaux pour expliquer les profils observés de distribution des bactéries PAA. Il a été suggéré que les teneurs en azote (Waidner & Kirchman 2007) pourraient expliquer cette distribution, ou bien l'importance du mode de vie libre/attaché aux particules (Waidner & Kirchman 2007 , Yutin et al. 2007).
Enfin, très peu de suivis dans le temps de ce groupe fonctionnel ont été effectués. Seuls Fuhrman et al. (2006) ont montré des abondances très variables de bactéries PAA dans un environnement côtier sur une période de deux ans, et plus récemment, Zhang et al. (2007) ont suggéré l'existence de profils saisonniers pour certaines des communautés échantillonnées en Mer de Chine.
Les bactéries PAA ne semblent pas jouer de rôle significatif dans la fixation du CO2. La RUBISCO (Ribulose 1,5 bisphosphate carboxyllase oxygénase) est absente chez les souches isolées et le séquençage récent du génome complet de Roseobacter denitrificans suggère que les faibles taux de fixation du CO2 mesurés chez certaines espèces sont liés à l'existence de réactions anaplérotiques, alimentant le cycle de Krebs (Swingley et al. 2007). En revanche, ces procaryotes pourraient jouer un rôle significatif dans la fixation du CO, un gaz à effet de serre, mais peu de données permettent de discuter de cette éventualité.
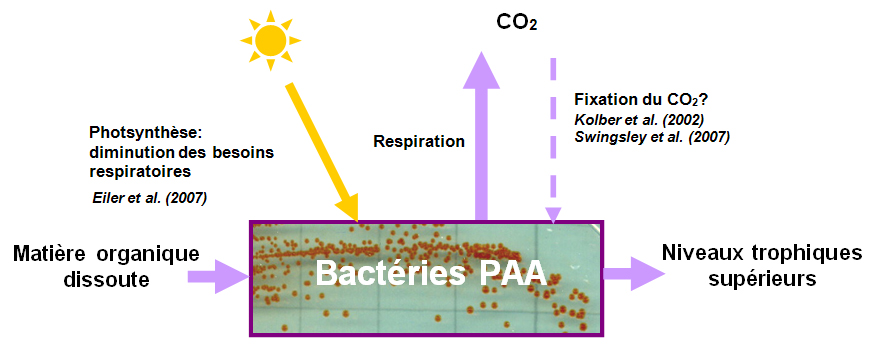
Importance des bactéries PAA dans le cycle du carbone des océans. Ces bactéries utilisent la matière organique dissoute, sont absorbées par les niveaux trophiques supérieurs, perdent du carbone par la respiration. Leurs capacités de photosynthèse diminuent leurs besoins respiratoires (production d'ATP). Certains auteurs suggèrent que ces bactéries pourraient fixer le CO2, mais la réalité environnementale de cette fixation reste controversée et pourrait être faible.
Bibliographie
- Béjà O, Suzuki MT, Heidelberg JF, Nelson WC, Preston CM, Hamada T, Elsen JA, Fraser CM, DeLong EF (2002) Unsuspected diversity among marine aerobic anoxygenic phototrophs. Nature 415:630-633
- Cho JC, Giovannoni SJ (2004) Cultivation and growth characteristics of a diverse group of oligotrophic marine Gammaproteobacteria. Appl. Environ. Microbiol. 70:432-440
- Cottrell MT, Mannino A, Kirchman DL (2006) Aerobic anoxygenic phototrophic bacteria in the Mid-Atlantic Bight and the North Pacific Gyre. Appl. Environ. Microbiol. 72:557-564
- Du H, Jiao N, Hu Y, Zeng Y (2006) Real-time PCR for quantification of aerobic anoxygenic phototrophic bacteria based on pufM gene in marine environment. J. Exp. Mar. Biol. Ecol. 329:113-121
- Fukuda R, Ogawa H, Nagata T, Koike I (1998) Direct determination of carbon and nitrogen contents of natural bacterial assemblages in marine environments. Appl. Environ. Microbiol. 64:3352-3358
- Koblizek M, Ston-Egiert J, Sagan S, Kolber ZS (2005) Diel changes in bacteriochlorophyll a concentration suggest rapid bacterioplankton cycling in the Baltic Sea. FEMS Microbiol. Ecol. 51:353-361
- Kolber ZS, Van Dover CL, Niederman RA, Falkowski PG (2000) Bacterial photosynthesis in surface waters of the open ocean. Nature 407:177-179
- Kolber ZS, Plumley FG, Lang AS, Beatty JT, Blankenship RE, VanDover CL, Vetriani C, Koblizek M, Rathgeber C, Falkowski PG (2001) Contribution of aerobic photoheterotrophic bacteria to the carbon cycle in the ocean. Science 292:2492-2495
- Mullins TD, Britschgi TB, Krest RL, Giovannoni SJ (1995) Genetic comparisons reveal the same unknown bacterial lineages in Atlantic and Pacific bacterioplankton communities. Limnol. Oceanogr. 40:148-158
- Nianzhi J, Sieracki ME, Zhang Y, Hailian DU (2003) Aerobic anoxygenic phototrophic bacteria and their roles in marine ecosystems. Chinese Science Bulletin 48:1064-1068
- Oz A, Sabehi G, Koblizek M, Massana R, Beja O (2005) Roseobacter-like bacteria in Red and Mediterranean sea aerobic anoxygenic photosynthetic populations. Appl. Environ. Microbiol. 71:344-353
- Rathgeber C, Beatty JT, Yurkov VV (2004) Aerobic phototrophic bacteria: new evidence for the diversity, ecological importance and applied potential of this previously overlooked group. Photosynth. Res. 81:113-128
- Schwalbach MS, Fuhrman JA (2005) Wide-ranging abundances of aerobic anoxygenic phototrophic bacteria in the world ocean revealed by epifluoresence microscopy and quantitative PCR. Limnol. Oceanogr. 50:620-628
- Sieracki ME, Gilg IC, Thier EC, Poulton NJ, Goericke R (2006) Distribution of planktonic aerobic anoxygenic photoheterotrophic bacteria in the Northwest Atlantic. Limnol. Oceanogr. 51:38-46
- Shiba T, Simidu U, Taga N (1979a) Another aerobic bacterium which contains bacteriochlorophyll a. Bulletin of the Japanese Society of Scientific Fisheries 45:801
- Shiba T, Simidu U, Taga N (1979b) Distribution of aerobic bacteria which contain bacteriochlorophyll a. Appl. Environ. Microbiol. 38:43-45
- Shiba T, Shioi Y, Takamiya KI, Sutton DC, Wilkinson CR (1991) Distribution and physiology of aerobic bacteria containing bacteriochlorophyll a on the East and West coast of Australia. Appl. Environ. Microbiol. 57:295-300
- Swingley WD, Sadekar S, Mastrian SD, Matthies HJ, Hao J, Ramos H, Acharya CR, Conrad AL, Taylor HL, Dejesa LC, Shah MK, O'Huallachain ME, Lince MT, Blankenship RE, Beatty JT, Touchman JW (2007) The complete genome sequence of Roseobacter denitrificans reveals a mixotrophic rather than photosynthetic metabolism. J. Bacteriol. 189:683-690
- Venter JC, Remington K, Heidelberg JF, Halpern AL, Rusch D, Eisen JA, Wu DY, Paulsen I, Nelson KE, Nelson W, Fouts DE, Levy S, Knap AH, Lomas MW, Nealson K, White O, Peterson J, Hoffman J, Parsons R, Baden-Tillson H, Pfannkoch C, Rogers YH, Smith HO (2004) Environmental genome shotgun sequencing of the Sargasso Sea. Science 304:66-74
- Waidner LA, Kirchman DL (2005) Aerobic anoxygenic photosynthesis genes and operons in uncultured bacteria in the Delaware River. Environ. Microbiol. 7:1896-1908
- Yurkov VV (1994) Phylogenetic positions of novel aerobic, bacteriochlorophyll a-containing bacteria and description of Roseococcus thiosulfatophilus gen. nov., sp. nov., Erythromicrobium ramosum gen. nov., sp. nov., and Erythrobacter litoralis. Int. J. Syst. Bacteriol. 44:427-434
- Yurkov VV, Beatty JT (1998a) Aerobic anoxygenic phototrophic bacteria. Microbiol. Mol. Biol. Rev. 62:695-724
- Yurkov VV, Beatty JT (1998b) Isolation of aerobic anoxygenic photosynthetic bacteria from black smoker plume waters of the Juan de Fuca ridge in the Pacific Ocean. Appl. Environ. Microbiol. 64:337-341
- Yurkov VV, Krieger S, Stackebrandt E, Beatty JT (1999) Citromicrobium bathyomarinum, a novel aerobic bacterium isolated from deep-sea hydrothermal vent plume waters that contains phototsynthetic pigment-protein complexes. J. Bacteriol. 181:4157-4525
- Yutin N, Suzuki MT, Béjà O (2005) Novel primers reveal wider diversity among marine aerobic anoxygenic phototrophs. Appl. Environ. Microbiol. 71:8958-8962
- Yutin N, Suzuki MT, Teeling H, Weber M, Venter JC, Rusch DB, Béjà O (2007) Assessing diversity and biogeography of aerobic anoxygenic phototrophic bacteria in surface waters of the Atlantic and Pacific Oceans using the Global Ocean Sampling expedition metagenomes. Environ. Microbiol. 9:1464-1475
- Zhang Y, Jiao N (2007) Dynamics of aerobic anoxygenic phototrophic bacteria in the East China Sea. FEMS Microb. Ecol. 61:459-469

